Resistència a la corrosió dels metalls
Què és la resistència a la corrosió?
La capacitat d'un metall per resistir la corrosió s'anomena resistència a la corrosió. Aquesta capacitat està determinada per la velocitat de corrosió en determinades condicions. Per avaluar el grau de corrosió s'utilitzen característiques quantitatives i qualitatives.

Les característiques qualitatives són:
-
canviar l'aspecte de la superfície metàl·lica;
-
canvi en la microestructura del metall.
Les característiques quantitatives són:
-
temps abans de l'aparició del primer focus de corrosió;
-
el nombre de focus de corrosió formats durant un període de temps determinat;
-
aprimament del metall per unitat de temps;
-
canvi de massa de metall per unitat d'àrea per unitat de temps;
-
el volum de gas absorbit o alliberat durant la corrosió per unitat de superfície per unitat de temps;
-
densitat de corrent elèctric per a una taxa de corrosió determinada;
-
canvi de propietat durant un període de temps (propietats mecàniques, reflectivitat, resistència elèctrica).
Els diferents metalls tenen diferent resistència a la corrosió.Per augmentar la resistència a la corrosió, s'utilitzen mètodes especials: aliatge d'acer, cromat, alumini, niquelat, pintura, recobriment de zinc, passivació, etc.
Ferro i acer

En presència d'oxigen i aigua pura, el ferro es corroeix ràpidament, la reacció continua segons la fórmula:
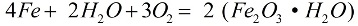
En el procés de corrosió, una capa solta d'òxid cobreix el metall, i aquesta capa no el protegeix en absolut d'una destrucció posterior, la corrosió continua fins que el metall es destrueix completament. La corrosió més activa del ferro és causada per solucions de sal: si fins i tot hi ha una mica de clorur d'amoni (NH4Cl) a l'aire, el procés de corrosió anirà molt més ràpid. En una solució feble d'àcid clorhídric (HCl), la reacció també es produirà activament.
L'àcid nítric (HNO3) en una concentració superior al 50% conduirà a la passivació del metall: estarà cobert amb una capa protectora, encara que fràgil. L'àcid nítric vaporitzat és segur per al ferro.
L'àcid sulfúric (H2SO4) en una concentració superior al 70% passiva el ferro, i si la classe d'acer St3 s'emmagatzema en àcid sulfúric al 90% a una temperatura de 40 ° C, en aquestes condicions la taxa de corrosió no superarà les 140 micres per any. Si la temperatura és de 90 ° C, la corrosió continuarà a un ritme 10 vegades superior. L'àcid sulfúric amb una concentració de ferro del 50% es dissol.
L'àcid fosfòric (H3PO4) no corroirà el ferro, ni els dissolvents orgànics anhidres com les solucions alcalines, l'amoníac aquós, el Br2 sec i el Cl2.
Si afegiu una mil·lèsima part de cromat de sodi a l'aigua, es convertirà en un excel·lent inhibidor de la corrosió del ferro, com l'hexametafosfat de sodi. Però els ions de clor (Cl-) eliminen la pel·lícula protectora del ferro i augmenten la corrosió.El ferro és tècnicament pur, conté aproximadament un 0,16% d'impureses i és molt resistent a la corrosió.
Acers mig aliats i poc aliats
Les addicions d'aliatge de crom, níquel o coure en acers poc aliats i mig aliats augmenten la seva resistència a l'aigua i a la corrosió atmosfèrica. Com més crom, més gran és la resistència a l'oxidació de l'acer. Però si el crom és inferior al 12%, els mitjans químicament actius tindran un efecte destructiu sobre aquest acer.
Acers d'alt aliatge
En els acers altament aliats, els components d'aliatge són més del 10%. Si l'acer conté entre un 12 i un 18% de crom, aquest acer suportarà el contacte amb gairebé qualsevol dels àcids orgànics, amb els aliments, serà resistent a l'àcid nítric (HNO3), bases i moltes solucions de sal. En un 25% d'àcid fòrmic (CH2O2), l'acer d'alt aliatge es corroeix a una velocitat d'uns 2 mm per any. Tanmateix, els agents reductors forts, l'àcid clorhídric, els clorurs i els halògens destruiran l'acer d'alt aliatge.
Els acers inoxidables que contenen entre un 8 i un 11% de níquel i entre un 17 i un 19% de crom són més resistents a la corrosió que només els acers amb alt crom. Aquests acers resisteixen mitjans oxidants àcids, com l'àcid cròmic o l'àcid nítric, així com els alcalins forts.
El níquel com a additiu augmentarà la resistència de l'acer a ambients no oxidants, als factors atmosfèrics. Però l'entorn és àcid, reductor i àcid amb ions halogens, destruiran la capa d'òxid passivant, com a resultat, l'acer perdrà la seva resistència als àcids.
Els acers inoxidables amb l'addició de molibdè en una quantitat d'1 a 4% tenen una major resistència a la corrosió que els acers al crom-níquel.El molibdè donarà resistència a l'àcid sulfúric i sulfúric, àcids orgànics, aigua de mar i halogenurs.
El ferrosilici (ferro amb una addició del 13 al 17% de silici), l'anomenada fosa de ferro-silici, té resistència a la corrosió per la presència d'una pel·lícula d'òxid de SiO2 i que ni els àcids sulfúric, ni nítric ni cròmic poden destruir, només enforteixen aquesta pel·lícula protectora. Però l'àcid clorhídric (HCl) corroirà fàcilment el ferrosilici.
Aliatges de níquel i níquel pur

El níquel és resistent a molts factors, tant atmosfèrics com de laboratori, a l'aigua neta i salada, a sals alcalines i neutres com carbonats, acetats, clorurs, nitrats i sulfats. Els àcids orgànics no oxigenats i no calents no perjudiquen el níquel, així com l'hidròxid de potassi alcalí concentrat (KOH) bullint en una concentració de fins al 60%.
La corrosió és causada per mitjans reductors i oxidants, sals alcalines o àcides oxidants, àcids oxidants com el nitrogen, halògens gasosos humits, òxids de nitrogen i diòxid de sofre.
El metall Monel (fins a un 67% de níquel i fins a un 38% de coure) és més resistent als àcids que el níquel pur, però no suportarà l'acció dels àcids oxidants forts. Es diferencia en una resistència bastant alta als àcids orgànics, a una quantitat important de solucions salines. La corrosió atmosfèrica i l'aigua no amenacen el metall monel; el fluor també és segur per a ell. El metall Monel suportarà amb seguretat un 40% de fluorur d'hidrogen (HF) en ebullició com el platí.
Aliatges d'alumini i alumini pur

La pel·lícula protectora d'òxid d'alumini fa que sigui resistent als oxidants comuns, l'àcid acètic, el fluor, només l'atmosfera i una quantitat significativa de líquids orgànics.L'alumini tècnicament pur, en què les impureses són inferiors al 0,5%, és molt resistent a l'acció del peròxid d'hidrogen (H2O2).
Es destrueix per l'acció de bases càustiques en un ambient fortament reductor. L'àcid sulfúric diluït i l'oli no són terribles per a l'alumini, però l'àcid sulfúric de força mitjana el destruirà, igual que l'àcid nítric calent.
L'àcid clorhídric pot destruir la pel·lícula protectora d'òxid d'alumini. El contacte de l'alumini amb mercuri o sals de mercuri és destructiu per als primers.
L'alumini pur és més resistent a la corrosió que, per exemple, l'aliatge de duralumini (en el qual fins a un 5,5% de coure, 0,5% de magnesi i fins a un 1% de manganès), que és menys resistent a la corrosió. El silumin (afegit de l'11 al 14% de silici) és més estable en aquest sentit.
Aliatges de coure i coure pur

El coure pur i els seus aliatges no es corroeixen en aigua salada o aire. El coure no té por de la corrosió: bases diluïdes, NH3 sec, sals neutres, gasos secs i la majoria de dissolvents orgànics.
Els aliatges com el bronze, que contenen molt coure, resisteixen l'exposició a àcids, fins i tot àcid sulfúric concentrat en fred o diluït en calent, o àcid clorhídric concentrat o diluït a temperatura ambient (25 °C).
En absència d'oxigen, el coure no es corroeix en contacte amb els àcids orgànics. Ni el fluor ni el fluorur d'hidrogen sec tenen un efecte destructiu sobre el coure.
Però els aliatges de coure i el coure pur es corroeixen per diversos àcids si hi ha oxigen, així com en contacte amb NH3 humit, algunes sals àcides, gasos humits com l'acetilè, CO2, Cl2, SO2. El coure interacciona fàcilment amb el mercuri, el llautó (zinc i coure) no és altament resistent a la corrosió.
Consulteu més detalls aquí - Coure i alumini en enginyeria elèctrica
Zinc pur

L'aigua neta, com l'aire net, no corroeix el zinc. Però si hi ha sals, diòxid de carboni o amoníac a l'aigua o a l'aire, començarà la corrosió del zinc. El zinc es dissol en bases, especialment ràpidament —en àcid nítric (HNO3), més lentament— en àcids clorhídric i sulfúric.
Els dissolvents orgànics i els productes derivats del petroli generalment no tenen efectes corrosius sobre el zinc, però si el contacte es prolonga, per exemple amb la gasolina esquerdada, l'acidesa de la gasolina augmentarà a mesura que s'oxida a l'aire i començarà la corrosió del zinc.
Plom pur

L'alta resistència del plom a l'aigua i a la corrosió atmosfèrica és un fet conegut. No es corroeix Jo condueixo i quan al sòl. Però si l'aigua conté molt diòxid de carboni, el plom s'hi dissoldrà, ja que es forma bicarbonat de plom, que ja serà soluble.
En general, el plom és molt resistent a solucions neutres, moderadament resistent a solucions alcalines, així com a alguns àcids: sulfúric, fosfòric, cròmic i sulfúric. Amb àcid sulfúric concentrat (a partir del 98%) a una temperatura de 25 ° C, el plom es pot dissoldre lentament.
El fluorur d'hidrogen a una concentració del 48% dissol el plom quan s'escalfa. El plom reacciona fortament amb els àcids clorhídric i nítric, amb l'àcid fòrmic i acètic. L'àcid sulfúric cobrirà el plom amb una capa lleugerament soluble de clorur de plom (PbCl2) i la dissolució posterior no procedirà. En l'àcid nítric concentrat, el plom també estarà recobert amb una capa de sal, però l'àcid nítric diluït el dissolrà. Els clorurs, carbonats i sulfats no són agressius cap al plom, mentre que les solucions de nitrats són el contrari.
Titani pur

Una bona resistència a la corrosió és un segell distintiu del titani.No s'oxida per oxidants forts, suporta solucions salines, FeCl3, etc. Els àcids minerals concentrats provocaran corrosió, però fins i tot l'àcid nítric bullint en una concentració inferior al 65%, l'àcid sulfúric - fins al 5%, l'àcid clorhídric - fins al 5% - no provocarà corrosió del titani. La resistència normal a la corrosió de bases, sals alcalines i àcids orgànics distingeix el titani d'altres metalls.
Zirconi pur

El zirconi és més resistent a l'àcid sulfúric i clorhídric que el titani, però menys resistent a l'aquarègia i al clor humit. Té una alta resistència química a la majoria de bases i àcids, resistent al peròxid d'hidrogen (H2O2).
L'acció de certs clorurs, l'àcid clorhídric concentrat bullint, l'aigua regia (una mescla d'HNO3 nítric concentrat (65-68%) i HCl salí (32-35% en pes), l'àcid sulfúric concentrat calent i l'àcid nítric fumant-causa Pel que fa a la corrosió, aquesta és una propietat del zirconi com la hidrofobicitat, és a dir, aquest metall no està mullat ni per aigua ni per solucions aquoses.
Tàntal pur

L'excel·lent resistència química del tàntal és similar al vidre. La seva densa pel·lícula d'òxid protegeix el metall a temperatures de fins a 150 ° C de l'acció del clor, brom, iode. La majoria dels àcids en condicions normals no actuen sobre el tàntal, fins i tot l'aquarègia i l'àcid nítric concentrat no causen corrosió. Les solucions alcalines pràcticament no tenen cap efecte sobre el tàntal, però el fluorur d'hidrogen actua sobre ell, i s'utilitzen solucions alcalines calentes concentrades, s'utilitzen fundes alcalines per dissoldre el tàntal.
