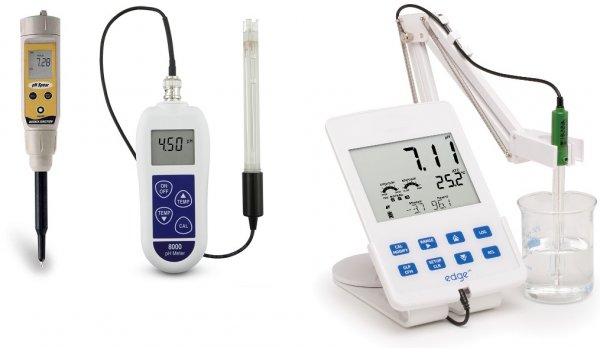
El principi de mesura de pH, dispositiu i tipus de mesuradors de pH
Per determinar ràpidament el nivell de pH (és a dir, el nivell d'acidesa) de diversos mitjans, s'utilitzen pHmetres. Aigua industrial o potable, solució àcida, sal o àlcali, sang, orina i altres fluids corporals, fruites, verdures i altres aliments, medicaments mèdics, etc. — en principi, tot pot esdevenir objecte d'investigació operativa valor pH.
La mesura del PH és essencialment una mesura de l'activitat dels ions d'hidrogen en un medi. I fins i tot la pròpia designació pH es tradueix literalment del llatí "pondus Hydrogenii" com "pes d'hidrogen".
Avui en dia, els mesuradors de pH s'utilitzen àmpliament en microbiologia i medicina, en tractament d'aigües i agroquímica, en ciències del sòl, en hidroponia, en investigació de laboratori i de camp, en indústries química i alimentària, en aquarística i en molts altres llocs.
El modern mesurador de pH us permet determinar amb precisió i rapidesa el valor de pH.Si el pH és 7, el medi és neutre, com l'aigua destil·lada, en què els ions d'hidrogen positius H + i els ions d'hidròxid negatius OH- es divideixen a parts iguals. Si l'acidesa és superior a 7, el medi és alcalí. Si el pH és inferior a 7, el medi és àcid.
I tot i que els químics sempre han estat capaços de determinar l'acidesa del medi pel mètode clàssic, utilitzant indicadors, per exemple, la fenolftaleïna, no obstant això, en alguns processos només cal quantificar amb precisió aquest indicador i, de vegades, cal fer un seguiment constant. això, per organitzar-lo per corregir-lo. Per això es van inventar els mesuradors de pH.
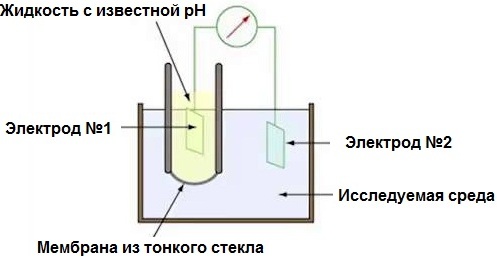
El mesurador de pH és en realitat un mil·livoltòmetre electrònic, ja que mesura la diferència de potencial entre el sistema electroquímic d'un parell d'elèctrodes i el medi de prova en el qual es col·loquen. És cert que l'escala del dispositiu es gradua aquí no en mil·livolts, sinó en pH, ja que la FEM mesurada resulta ser proporcional al pH.
Dos elèctrodes: un indicador de vidre (els oxidants no tenen por del vidre de borosilicat) i el clorur de plata, un elèctrode de referència addicional. L'elèctrode de vidre té una resistència molt alta de desenes de megaohms, i aquest és només el requisit bàsic: la resistència de la sonda no hauria de ser inferior a 0,1 GΩ. El mesurador de pH es calibra amb solucions tampó de pH conegut.
A causa del fet que el valor EMF es veu afectat per la temperatura, cada dispositiu de mesura té una compensació de temperatura per a mesures a temperatures diferents de + 25 ° C.Però per aconseguir una precisió molt alta, cal mesurar amb precisió a una temperatura de + 25 ° C, per això molts pHmetres estan equipats amb un termòmetre integrat, de manera que podeu seguir immediatament la temperatura del medi en el procés de recerca.
L'elèctrode de vidre indicador en forma de tub amb una bola de parets primes a l'extrem, fet d'un vidre borosilicat especial conductor elèctricament, està essencialment connectat a un circuit elèctric. El moviment d'ions H + positius dins d'un vidre d'aquest tipus permet utilitzar-lo (els cations dins del vidre es mouen en relació amb el polianió de l'àcid silícic). S'aboca una suspensió de clorur de plata en una solució d'àcid clorhídric al tub d'assaig, després de la qual s'hi submergeix un cable de plata: així s'obté un elèctrode de clorur de plata.
L'elèctrode de vidre es baixa al medi de prova, el circuit elèctric es tanca col·locant-hi un elèctrode de referència addicional (pasta de mercuri-calomel en solució de clorur de potassi) (mitjançant un interruptor electrolític o directament). El clorur de potassi crea contacte entre la porció de mercuri-calomel de la cèl·lula i el medi de prova. Aquest elèctrode addicional se sol col·locar en una caixa de vidre que és impermeable als ions H +.
El contacte conductor de la solució de clorur de potassi de l'elèctrode de referència amb la solució de prova es forma a causa d'un fil o capil·lar prim en una caixa de vidre, d'aquesta manera s'obté una cel·la galvànica a partir d'un elèctrode de referència i un elèctrode de clorur de plata, i la part d'electròlit de la cèl·lula inclou una pel·lícula de vidre conductora i un entorn de prova.
L'EMF del sistema d'elèctrodes es mesura amb un mil·livoltòmetre, la seva escala es gradua en pH.Els electrons de l'elèctrode de clorur de plata es transfereixen a l'elèctrode de referència sota l'acció de l'EMF mesurat, que sempre va acompanyat de la transferència d'un nombre igual de protons des de l'interior de l'elèctrode de vidre al medi.
Si en aquest cas prenem la concentració d'ions d'hidrogen positius H + en la constant de l'elèctrode de vidre, aleshores l'EMF serà una funció de l'activitat de H +, és a dir, una funció del pH del medi en estudi.
Els models moderns de pHmetres funcionen gràcies a microprocessadors que realitzen compensacions de temperatura i resolen moltes tasques relacionades. Com més complex sigui el dispositiu, més tasques pot resoldre. La classe de precisió dels instruments varia segons el model i es pot seleccionar un mesurador de pH adequat per a diferents aplicacions.
Hi ha mesuradors de pH domèstics de butxaca, de laboratoris professionals, portàtils i estacionaris industrials. Alguns pHmetres mesuren la concentració d'ions en el medi, el contingut de nitrats, etc., tenen una memòria incorporada per emmagatzemar els resultats, la capacitat de comunicar-se amb un ordinador i la funció d'ajustar paràmetres mitjançant un bucle de retroalimentació.