Com funcionen i funcionen les piles
 En el sentit més ampli de la paraula en tecnologia, el terme "bateria" es refereix a un dispositiu que en determinades condicions de funcionament permet acumular un determinat tipus d'energia i, en altres, utilitzar-la per a necessitats humanes.
En el sentit més ampli de la paraula en tecnologia, el terme "bateria" es refereix a un dispositiu que en determinades condicions de funcionament permet acumular un determinat tipus d'energia i, en altres, utilitzar-la per a necessitats humanes.
S'utilitzen on cal recollir energia durant un temps determinat i després utilitzar-la per dur a terme grans processos que requereixen mà d'obra. Per exemple, els acumuladors hidràulics utilitzats a les rescloses permeten que els vaixells pugin a un nou nivell a la llera del riu.
Les bateries elèctriques funcionen amb l'electricitat segons el mateix principi: primer, acumulen (acumulen) electricitat d'una font de càrrega externa i després la donen als consumidors connectats perquè treballin. Per la seva naturalesa, pertanyen a fonts de corrent químic capaços de dur a terme cicles periòdics de descàrrega i càrrega repetidament.
Durant el funcionament, les reaccions químiques tenen lloc constantment entre els components de les plaques d'elèctrode amb la seva substància d'ompliment - electròlit.
Un diagrama esquemàtic d'un dispositiu de bateria es pot representar mitjançant un dibuix simplificat quan s'insereixen dues plaques de metalls diferents amb cables al cos del vaixell per proporcionar contactes elèctrics. S'aboca un electròlit entre les plaques.
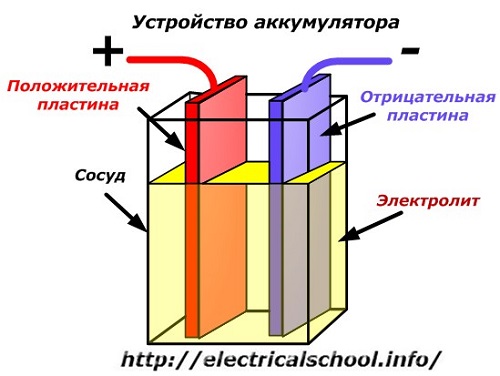
Funcionament de la bateria quan està descarregada
Quan una càrrega, com una bombeta, està connectada als elèctrodes, es crea un circuit elèctric tancat pel qual flueix el corrent de descàrrega. Es forma pel moviment d'electrons en peces metàl·liques i anions amb cations a l'electròlit.
Aquest procés es mostra convencionalment en un diagrama amb un disseny d'elèctrode de níquel-cadmi.
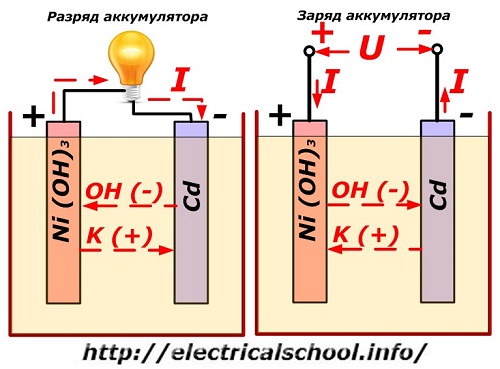
Aquí, s'utilitzen òxids de níquel amb additius de grafit, que augmenten la conductivitat elèctrica, com a material de l'elèctrode positiu. El metall de l'elèctrode negatiu és el cadmi esponjós.
Durant la descàrrega, les partícules d'oxigen actiu dels òxids de níquel s'alliberen a l'electròlit i es dirigeixen a les plaques negatives, on s'oxida el cadmi.
Rendiment de la bateria durant la càrrega
Quan s'apaga la càrrega, s'aplica una tensió constant (en determinades situacions, pulsant) als terminals de la placa d'un valor superior al d'una bateria carregada de la mateixa polaritat, quan coincideixen els terminals més i menys de la font i del consumidor. .
El carregador sempre té més potència, que "suprimeix" l'energia residual de la bateria i crea un corrent elèctric en sentit contrari a la descàrrega. Com a resultat, els processos químics interns entre els elèctrodes i l'electròlit canvien. Per exemple, en una caixa de plaques de níquel-cadmi, l'elèctrode positiu s'enriqueix amb oxigen i el negatiu - a un estat de cadmi pur.
Quan la bateria es descarrega i es carrega, la composició química del material de les plaques (elèctrodes) canvia, però l'electròlit no canvia.
Mètodes de connexió de la bateria
Connexió paral·lel
La quantitat de corrent de descàrrega que pot suportar una persona depèn de molts factors, però principalment del disseny, els materials utilitzats i les seves dimensions. Com més gran sigui l'àrea de les plaques als elèctrodes, més gran és el corrent que poden suportar.
Aquest principi s'utilitza per connectar cel·les del mateix tipus en paral·lel a les bateries quan cal augmentar el corrent a la càrrega, però per carregar aquest disseny, caldrà augmentar la potència de la font. Aquest mètode rarament s'utilitza per a estructures ja fetes, ja que ara és molt més fàcil comprar immediatament la bateria necessària. Però els fabricants de bateries àcids l'utilitzen, connectant diferents plaques en blocs únics.
Connexió en sèrie
Depenent dels materials utilitzats, es pot generar una tensió d'1,2 / 1,5 o 2,0 volts entre les dues plaques d'elèctrodes de les bateries habituals en la vida quotidiana. (En realitat, aquest rang és molt més ampli.) Evidentment, no és suficient per a molts dispositius elèctrics. Per tant, les bateries del mateix tipus es connecten en sèrie, i això sovint es fa en un cas.
Un exemple d'aquest disseny és el desenvolupament generalitzat de l'automòbil basat en àcid sulfúric i plaques d'elèctrodes de plom.
En general, entre les persones, especialment entre els conductors de transport, és habitual anomenar bateria a qualsevol dispositiu, independentment del nombre dels seus elements constitutius: caixes. Tanmateix, això no és del tot correcte.L'estructura, acoblada a partir de diverses caixes connectades en sèrie, ja és una bateria, a la qual s'hi posa el nom abreujat «АКБ»... La seva estructura interna es mostra a la figura.
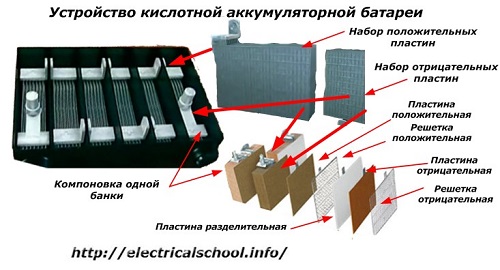
Cadascun dels pots consta de dos blocs amb un conjunt de plaques per als elèctrodes positius i negatius. Els blocs encaixen entre si sense contacte metàl·lic amb la possibilitat d'una connexió galvànica fiable a través de l'electròlit.
En aquest cas, les plaques de contacte tenen una graella addicional i estan separades entre si per una placa separadora.
Connectar les plaques en blocs augmenta la seva àrea de treball, redueix la resistència total de tota l'estructura i permet augmentar la potència de la càrrega connectada.
A l'exterior de la caixa, aquesta bateria té els elements que es mostren a la figura següent.
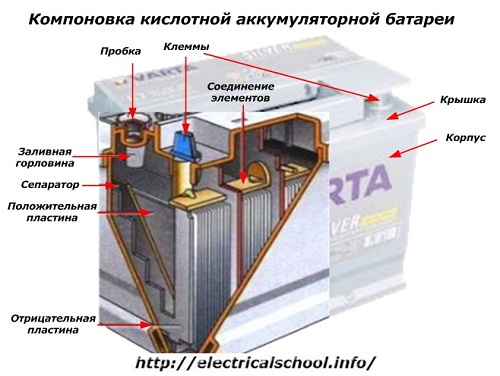
Mostra que la robusta carcassa de plàstic està segellada amb una tapa i equipada amb dos terminals (generalment en forma de con) a la part superior per a la connexió al circuit elèctric del cotxe. Les marques de polaritat estan estampades als seus terminals: «+» i «-«. En general, el terminal positiu té un diàmetre lleugerament més gran que el terminal negatiu per bloquejar els errors de cablejat.
Les bateries útils tenen un forat d'ompliment a la part superior de cada pot per controlar el nivell d'electròlit o afegir aigua destil·lada durant el funcionament. S'hi cargola un tap, que protegeix les cavitats internes de la caixa de la contaminació i alhora evita que l'electròlit es vessi quan la bateria està inclinada.
Atès que amb una càrrega potent és possible la gasació de l'electròlit (i aquest procés és possible durant la conducció intensiva), es fan forats als taps per evitar que augmenti la pressió dins de la caixa.L'oxigen i l'hidrogen, així com els vapors d'electròlits, surten per ells. Es recomana evitar aquestes situacions que impliquin corrents de càrrega excessives.
La mateixa figura mostra la connexió dels elements entre els bancs i la disposició de les plaques d'elèctrodes.
Les bateries d'arrencada de cotxes (plom àcid) funcionen segons el principi de doble sulfatació. Durant la descàrrega / càrrega, es produeix un procés electroquímic sobre ells, acompanyat d'un canvi en la composició química de la massa activa dels elèctrodes amb l'alliberament / absorció d'aigua a l'electròlit (àcid sulfúric).
Això explica l'augment de la gravetat específica de l'electròlit durant la càrrega i la disminució quan es descarrega la bateria. En altres paraules, el valor de densitat permet avaluar l'estat elèctric de la bateria. S'utilitza un dispositiu especial per mesurar-lo: un hidròmetre de cotxe.
L'aigua destil·lada, que forma part de l'electròlit de les bateries àcids, es converteix en un estat sòlid: gel a temperatures negatives. Per tant, per evitar que les bateries dels cotxes es congelin en temps fred, cal aplicar les mesures especials previstes a les normes. per a l'explotació.
Quins tipus de piles hi ha?
La producció moderna per a diversos propòsits produeix més de tres dotzenes de productes amb diferents composicions d'elèctrodes i electròlits. 12 models coneguts només funcionen amb liti.

El següent es pot trobar com a elèctrode metàl·lic:
-
dirigir;
-
ferro;
-
liti;
-
titani;
-
cobalt;
-
cadmi;
-
níquel;
-
zinc;
-
plata;
-
vanadi;
-
alumini
-
alguns altres elements.
Afecten les característiques de sortida elèctrica i, per tant, l'aplicació.
La capacitat de suportar càrregues elevades a curt termini derivades de la rotació dels cigonyals dels motors de combustió interna mitjançant motors d'arrencada elèctrics és característica de les bateries de plom-àcid. S'utilitzen àmpliament en el transport, les fonts d'alimentació ininterrompuda i els sistemes d'alimentació d'emergència.
Estàndard cèl·lules galvàniques (bateries normals) solen ser substituïdes per bateries de níquel-cadmi, níquel-zinc i níquel-hidrur metàl·lic.
Però els dissenys d'ions de liti o de polímers de liti funcionen de manera fiable en dispositius mòbils i informàtics, eines de construcció i fins i tot vehicles elèctrics.
Segons el tipus d'electròlit utilitzat, les bateries són:
-
àcid
-
alcalí.
Hi ha una classificació de bateries segons la finalitat. Per exemple, en condicions modernes, han aparegut dispositius que s'utilitzen per a la transferència d'energia, per recarregar altres fonts. L'anomenada bateria externa ajuda els propietaris de molts dispositius mòbils en absència d'una xarxa elèctrica alterna. És capaç de carregar repetidament una tauleta, un telèfon intel·ligent, un telèfon mòbil.
Totes aquestes bateries tenen el mateix principi de funcionament i un dispositiu similar. Per exemple, el model de dit d'ió de liti que es mostra a la figura següent de moltes maneres repeteix el disseny de les bateries d'àcid comentat anteriorment.
Aquí veiem els mateixos elèctrodes de contacte, plaques, separador i carcassa. Només es fan tenint en compte altres condicions laborals.
Característiques elèctriques bàsiques d'una bateria
El funcionament del dispositiu es veu afectat pels paràmetres:
-
capacitat;
-
densitat d'energia;
-
autodescàrrega;
-
règim de temperatura.
La capacitat s'anomena càrrega màxima de la bateria, que és capaç de donar durant la descàrrega a la tensió més baixa. S'expressa en penjolls (sistema SI) i amperes-hora (unitat no sistema).
Com a tipus de capacitat hi ha «capacitat energètica», que determina l'energia alliberada durant la descàrrega a la tensió mínima admissible. Es mesura en joules (SI) i watts-hora (unitats no SI).
La densitat d'energia expressada com la relació entre la quantitat d'energia i el pes o el volum de la bateria.
L'autodescàrrega considera la pèrdua de capacitat després de la càrrega en absència de càrrega als terminals. Això depèn del disseny i s'agreuja per ruptures d'aïllament entre els elèctrodes per moltes raons.
La temperatura de funcionament afecta les propietats elèctriques i en cas de desviacions greus de la norma especificada pel fabricant, pot danyar la bateria. La calor i el fred són inacceptables, afecten el curs de les reaccions químiques i la pressió de l'ambient dins de la caixa.
